De hardheid van water is een van de belangrijkste criteria die de consumenteneigenschappen bepalen. Het vormt onoplosbare minerale afzettingen op de binnenkant van elektrische apparaten en industriële apparatuur en leidt tot verslechtering van hun operationele eigenschappen. Om de kwaliteit van water te beoordelen, worden de toegestane limieten van de indicator vastgesteld.
Inhoud artikel
Hoe hardheidszouten worden gevormd
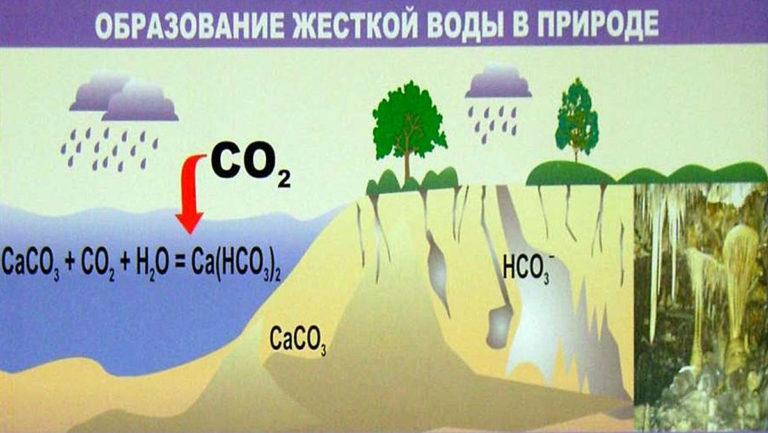
Water is een universeel oplosmiddel. De samenstelling van natuurlijke bronnen is afhankelijk van het type terrein. Water met opgeloste kooldioxide dringt de bodem binnen, gaat door de dikte van geologische rotsen - gips, dolomiet, calciet, erodeert ze, verrijkt met organische en minerale stoffen, metaalionen. Zij vormen de totale mineralisatie van water(TDS).
Calcium en magnesium kationen overheersen, hun totale waarde geeft de totale hardheid van water. Deze wordt onderverdeeld in twee soorten:
- tijdelijk (carbonaat);
- permanent (niet-carbonaat).
De formule voor totale hardheid is als volgt:
Zho = [Ca2+] + [Mg2+] = Zhk + Zhnk
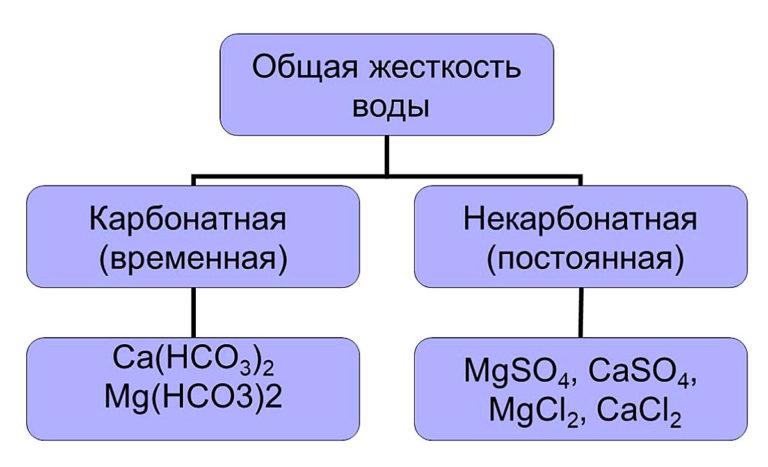
Carbonaathardheid wordt veroorzaakt door de aanwezigheid van koolwaterstoffen Ca(HCO3)2 en Mg(HCO3)2. Ze worden gemakkelijk uit de oplossing verwijderd en vormen een onoplosbaar neerslag bij het koken. De tweede soort hardheid bepaalt het gehalte aan oplosbare zouten in water, die niet door verhitting verwijderd kunnen worden. Om permanente hardheid te verwijderen, worden verschillende methoden gebruikt die verderop in dit artikel worden beschreven.
In tegenstelling tot ondergrondse bronnen bevat oppervlaktewater minder zouten, omdat het voortdurend wordt verdund door neerslag. Het hardheidsniveau is variabel. Het bereikt zijn maximumwaarden in de winter en tijdens overstromingen neemt het af. In grondwater is deze indicator stabieler. In grondwater is deze indicator stabieler.
Meeteenheden
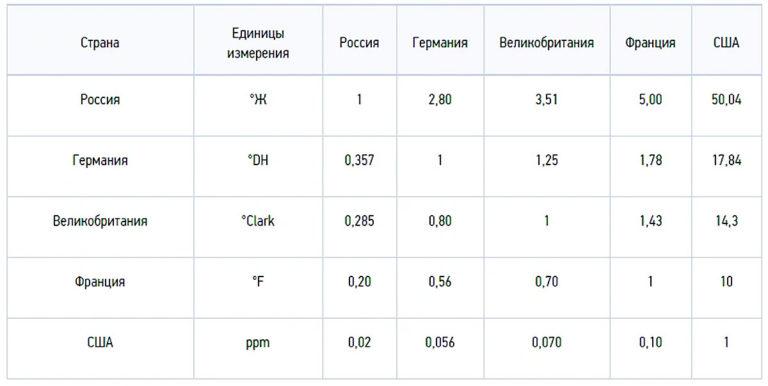
Zoutconcentratie wordt gemeten in milligram equivalenten per liter: 1 mg-eq/L = 20,04 mg Ca2+ en 12,16 mg Mg2+. In het internationale SI-stelsel wordt de indicator numeriek uitgedrukt in mol per meter3 (mol/m3). In ons land worden hardheidsgraden gebruikt, 1 ºJ = 1 mg-eq/L of 0,5 mmol/L.
Hardheidsgraden worden ook in andere landen gebruikt, maar verschillen in numerieke waarden:
- Duitse hardheidsgraad 1ºdH = 10 mg/L CaO of 7,194 mg/L MgO;
- Frans 1ºfH = 10 mg/L CaCO3;
- Engels 1ºClark = 14,254 mg/L CaCO3;
- Amerikaanse 1 gpg = 17,12 mg/L CaCO3.
Om te converteren naar andere meeteenheden is het handiger om een andere Amerikaanse eenheid te gebruiken - PPM (PPM), die gelijk is aan 1 mg/L. CaCO3. Vandaar:
- 1ºdH = 17,9 ppm;
- 1ºfH = 10,0 ppm;
- 1ºClark = 14,25 ppm;
- 1º gpg = 17,1 ppm;
- 1ºÆ = 50,05 ppm.
Om ppm om te rekenen naar onze handige ºÆ graden van hardheid, kunnen we een converter gebruiken. Een schaal kan worden gebruikt om te rekenen tussen graden:
1 ºJ = 2,804 ºdH = 3,5 ºClark = 5,005 ºfH = 2,924 gpg = 50,05ppm.
Hardheidsnormen
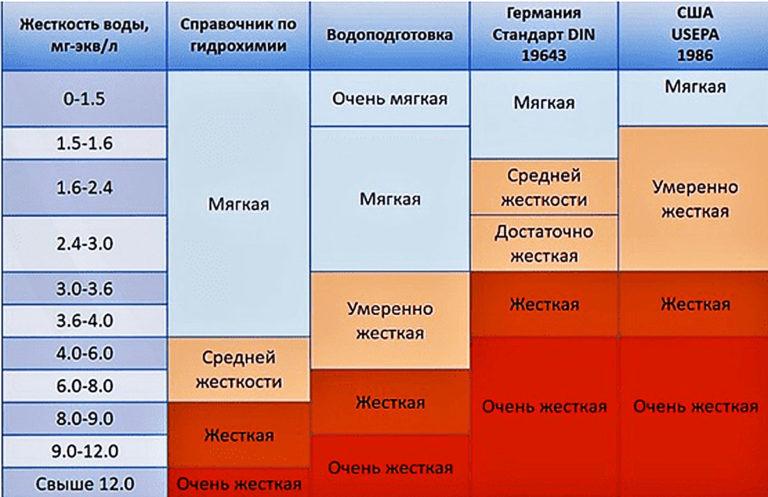
Volgens de parameter van totale hardheid wordt water onderscheiden:
- zacht - tot 4ºJ;
- gemiddelde hardheid - van 4 tot 8 ºJ;
- hard water - meer dan 8 ºJ.
De diversiteit van de natuurlijke omstandigheden in Rusland maakt het onmogelijk om uniforme hardheidsnormen voor alle regio's vast te stellen. De maximaal toelaatbare concentratie (MPC) van Ca2+ varieert sterk afhankelijk van de lokale omstandigheden.
De drinkwaternormen verschillen echter niet veel van de instellingen van de WHO (Wereldgezondheidsorganisatie). Als nationale norm is GOST 31954-2012 sinds 01.01.2014 van kracht in ons land. De norm houdt rekening met de belangrijkste internationale normen voor waterkwaliteit en analysemethoden. De norm is van toepassing op alle ondergrondse en oppervlaktebronnen.
Tabel 1. Normwaarden voor calcium- en magnesiumconcentraties in drinkwater
| № | Norm. document | Product | Ca, mg/l | Mg, mg/l | Graden, ºJ |
|---|---|---|---|---|---|
| 1 | СанПин_2.1.4.1074-01, GN_2.1.5.1315-03 |
Drinkwater | Niet gereguleerd | Niet gereguleerd | 7 |
| 2 | SanPin 2.1.4.1116-02 | Gebotteld water | 25-130 | 5 – 65 | 1,5-7 |
| 3 | WHO-normen | Drinkwater | 20-80 | 10 – 30 | Niet voorgesteld |
De samenstelling van water wordt bepaald door de hardheidsschaal, afhankelijk van het beoogde gebruik:
- aanvaardbare waarde voor leidingwater - 300 ppm of 6 ºJ;
- optimale waarde voor natuurlijke waterlichamen - binnen 400 ppm of 8 ºJ;
- het maximaal toegestane hardheidsniveau is 500 ppm, 10 ºJ;
- levensbedreigende zoutconcentraties - meer dan 500 ppm, > 10 ºJ.
Er worden bijzonder strenge eisen gesteld aan water dat wordt geleverd aan verwarmingsketels in energiecentrales - de indicator van totale hardheid mag niet hoger zijn dan 0,05-0,1 mg-eq/l.
Hoe bereken ik thuis de hardheid
Verhoogde hardheid wordt niet uitgedrukt door uiterlijke tekenen - geur, kleur, consistentie. Het blijkt uit:
- die aanslag vormt op de bodem van de ketel;
- slechte schuimvorming van wasmiddelen;
- witte strepen op de douchekop in de badkamer.

De exacte samenstelling van water kan alleen worden achterhaald met behulp van analyses. Maar thuis is er een eenvoudige manier om de hardheid van kraanwater te bepalen met een kleine fout van 1-2 graden.
Voor het experiment heb je nodig: een stuk wasmiddel, een kleine hoeveelheid gedestilleerd water, een elektronische weegschaal, een container, een cilindervormig glas, een liniaal.
- Rasp 1 g waszeep fijn en los het op in 3-4 eetlepels licht verwarmd gedestilleerd water. Als je geen keukenweegschaal bij de hand hebt, kun je op het oog afgaan - een halve theelepel zonder top.
- Giet gedestilleerd water in het glas met zeepoplossing zodat de hoogte van de vloeistofkolom overeenkomt met het percentage vetzuren dat is aangegeven op de zeepstaaf. Als 72%, moet de hoogte van de waterkolom 72 mm van de bodem van het bekerglas zijn, maar niet van het oppervlak van de tafel.
- Giet 0,5 liter kraanwater in een bak en giet er al roerend een dun straaltje zeepoplossing in. Eerst zullen er vlokken en bellen in het water verschijnen, daarna - een hardnekkig wit schuim. Dit geeft aan dat alle zouten al gebonden zijn.
Bereken het aantal centimeters waterkolom dat is overgelopen in de container, je kunt de hoogte van de overgebleven zeepoplossing aftrekken van het origineel:
hn= Hoi – ho,
waar:
- hn - hoogte van de kolom van de overgelopen oplossing;
- һi - hoogte van de waterkolom van de oorspronkelijke zeepoplossing;
- ho - hoogte van de kolom van de resterende zeepoplossing.
Elke centimeter oplossing die in de container wordt gegoten komt overeen met 2ºdH. De waarde komt overeen met de Duitse eenheid van hardheid. Bijvoorbeeld, 4,6 centimeter zijn gegoten uit een bekerglas, wat overeenkomt met 9,2 dH.
Je kunt de tabel gebruiken om de verkregen resultaten om te zetten in mg-eq/l, en a calculator voor exacte resultaten.
| № | Graden dH | Hardheidsniveau | Indicator in mg-eq/l |
|---|---|---|---|
| 1 | 0 – 4 | Zeer zacht | Tot 1,4 |
| 2 | 5 – 11 | Zacht | 1,8 – 4,0 |
| 3 | 12 – 22 | Medium | 4,3-8,0 |
| 4 | 22 – 34 | Hard | 8,0-12 |
| 5 | Meer dan 34 | Zeer stijf | Boven 12 |
Je kunt een nauwkeuriger resultaat krijgen met elektronische testers zoals de TDS-3. Deze analyseren het water op hardheid en zuurgraad en geven de resultaten weer op het scherm als RRM of pH. Deze analyseren water op hardheid en zuurgraad en geven de resultaten weer op het scherm als RRM of pH. Je kunt de RRM eenheden omrekenen naar ºJ met een rekenmachine.

Als je een gedetailleerde analyse wilt van het water in een put of boorgat, kun je dat doen met de "Well-1" kit.
Een andere eenvoudige en goedkope manier om de waterkwaliteit te bepalen - teststrips.

Effect van water
Op het menselijk lichaam
Tot op heden zijn er geen serieuze onderzoeken die de schadelijke effecten van hard water op het levende organisme bevestigen. Maar het is bekend dat langdurige consumptie van water met een verhoogde hardheid bijdraagt aan de ontwikkeling van urolithiasis. Het lichaam heeft geen tijd om overtollige sporenelementen te elimineren, wat leidt tot het verschijnen van urinestenen, nierstenen en afzettingen in de gewrichten.
De waterkwaliteit is ook van hygiënisch belang. Zeep, dat reageert met calcium- en magnesiumzouten, vernietigt de beschermlaag van de huid en veroorzaakt irritatie of allergieën. Haar wordt droog en broos.
Tegelijkertijd zijn calcium en magnesium belangrijke sporenelementen voor het menselijk leven:
- De dagelijkse hoeveelheid calcium is 1000 mg;
- magnesium - 400 mg.

Een tekort aan deze elementen kan ernstige aandoeningen in het lichaam veroorzaken. Volgens studies van de WHO leidt de consumptie van overmatig zacht water tot de uitloging van zouten uit het lichaam en veranderingen in de water-zoutbalans. In regio's waar zacht water wordt gebruikt:
- een toename van hart- en vaatziekten;
- een toename van het aantal breuken bij kinderen en een afname van het gewicht van pasgeborenen.
De WHO geeft aan dat de aanwezigheid van zouten in water beschouwd moet worden als een voorwaarde voor de normale vitale activiteit van het lichaam.
Over techniek
Hardheidszouten veroorzaken veel problemen bij het gebruik van huishoudelijke apparaten en industriële apparatuur:
Te zacht water heeft een negatief effect op apparaten en verhoogt het risico op corrosie van leidingen door een lage alkaliteit. Daarom is het noodzakelijk om de juiste balans van de water-zoutsamenstelling te handhaven.
Methoden voor waterontharding
Er zijn verschillende manieren om hardheid te verminderen. De keuze wordt bepaald door de initiële kwaliteit van het water, het doel en de gebruiksomstandigheden.
Thermische methode
Koken is de eenvoudigste en meest betaalbare manier om carbonaathardheid te verwijderen. Het is geschikt voor kleine hoeveelheden water voor huishoudelijk gebruik. De methode verwijdert echter niet alle hardheidszouten en vaatwerk moet ontkalkt worden.
Filtratie
Nog niet zo lang geleden was een wateronthardingsfilter een indrukwekkende installatie. Moderne technologie en materialen hebben het mogelijk gemaakt om compacte zuiveringssystemen te maken die water zacht maken en die gemakkelijk onder de gootsteen in de keuken passen. Vervangende filterpatronen ontharden niet alleen het water, maar verwijderen ook geuren en onzuiverheden. De juiste selectie van filters en tijdige vervanging garanderen waterzuivering van hoge kwaliteit uit de waterleiding, put of boorgat. Een van de moderne complexe systemen zijn filters "Barrier".

Chemische methoden
Om hardheidszouten neer te slaan, worden speciale reagentia aan het water toegevoegd - gebluste kalk, soda, polyfosfaten. De methode is effectief voor industrieel gebruik. Het grootste nadeel is de noodzaak voor verder gebruik van afval. Water na een dergelijke behandeling is ongeschikt voor voedingsdoeleinden.
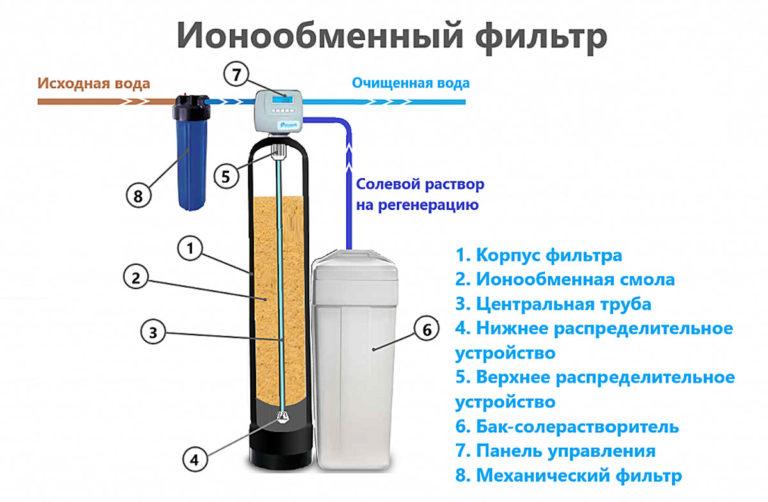
Ionenwisseling
Filtratie door middel van ionenwisselaarharsen wordt met succes toegepast in de industrie. Het principe is gebaseerd op de vervanging van kationen van aardalkalimetalen door natrium- en waterstofionen in een kolom met een fijnkorrelige vulling. Een oplossing van keukenzout wordt gebruikt om het gebruikte hars te regenereren. Als de hardheidsgraad van het water verandert, moeten de instellingen handmatig worden aangepast.
Fysieke methoden
Deze methoden zijn gebaseerd op de processen van elektrodialyse, ultrageluid en elektromagnetische pulsen. Hardheidszouten worden omgezet in een gewijzigde toestand waarin ze niet kristalliseren tot een vast neerslag, maar onstabiele verbindingen vormen. Het gebruik van ultrasone en elektromagnetische golven bevordert bovendien de onthechting van reeds bestaande kalkaanslag.
Membraanmethode
Deze zuiveringsmethode heeft een andere naam - omgekeerde osmose. Water onder hoge druk wordt door een filter met microscopische cellen geleid en volledig gezuiverd van chemische onzuiverheden, zwevende deeltjes en bacteriën. De kwaliteit van het verkregen water komt dicht in de buurt van gedestilleerd water. Voor gebruik is extra mineralisatie nodig. Het nadeel van deze methode zijn de hoge kosten.

Conclusie
Bij het beoordelen van de waterkwaliteit is het belangrijk om niet alleen te kijken naar de hardheid en de kans op kalkaanslag, maar ook naar de corrosiviteit. Met de juiste beoordeling kunt u een effectieve reeks maatregelen voor waterbehandeling kiezen.







Man, ik wist niet dat de hardheid van water apparaten kon beschadigen! Ik had ooit kalkaanslag in mijn koffiezetapparaat en dacht dat het toast was. Na wat onderzoek heb ik een waterontharder gekocht en nu werken mijn apparaten probleemloos. Goed om te weten dat er manieren zijn om dit aan te pakken!